「第2回エンペディア大賞」が2月いっぱい開催中です。2024年に作成された記事の中から、お気に入りの記事に投票しましょう!
ポリケチド合成酵素
ポリケチド合成酵素(Polyketide synthase:PKS)とは、ポリケチドを合成する多ドメイン酵素または酵素複合体である。真正細菌や真菌、植物、少数の動物が持つ。ポリケチドの生合成経路は脂肪酸のそれと多くの点で類似する[1][2]。
特定のポリケチド合成酵素の遺伝子は通常、細菌では一つのオペロン、真核生物では遺伝子集団に存在する。
分類[編集]
ポリケチド合成酵素は3つの群に分類される。
- I型 — 巨大なモジュールタンパク質
- II型 — 単機能タンパク質の集合
- III型 — ACPドメインを利用しない
I型ポリケチド合成酵素はさらに下記のように細分化される。
- 反復型ポリケチド合成酵素(Iterative PKS: IPKS) — 同一ドメインを繰り返し利用する。
- モジュール型ポリケチド合成酵素(Modular PKS) — 複数のモジュールから構成され、一つのモジュールが一回のポリケチド鎖伸長反応を触媒する(例外として独立したATドメイン(trans-AT)が繰り返し利用されることがある)。
さらに、反復型ポリケチド合成酵素は下記のように細分化される。
- 非還元型ポリケチド合成酵素(non-reducing PKS:NR-PKS) — 文字通りのポリケチドを合成する。
- 部分的還元型ポリケチド合成酵素(partially reducing PKS:PR-PKS)
- 全還元型ポリケチド合成酵素(fully reducing PKS:FR-PKS) — 脂肪酸誘導体を合成する。
モジュールとドメイン[編集]
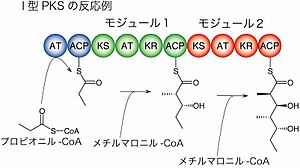
I型ポリケチド合成酵素の各モジュールはいくつかのドメインによって構成されており、お互いにスペーサー領域によって分離している。ポリケチド合成酵素のモジュールとドメインの構成は下記の通りである(上から下へN末端からC末端へと進む)。
- 開始または積込みモジュール: AT-ACP-
- 伸長または拡大モジュール: -KS-AT-[DH-ER-KR]-ACP-
- 終止または放出ドメイン: -TE
必須ドメイン:
- AT: アシル基転移酵素
- ACP: 翻訳後修飾により得られた補因子(セリンに結合した4-ホスホパンテテイン)のチオール基を持つアシル基運搬タンパク質
- KS: システイン側鎖のチオール基を持つケトン合成酵素
- TE: チオエステル加水分解酵素(サイクラーゼなどが付加することもある)
主要な修飾ドメイン:
その他のドメイン:
酵素反応の段階[編集]
ポリケチドの合成は、生成物の伸長を伴う重合反応である。
開始段階:
- スターター基質は通常アセチルCoA(またはその誘導体)であり、アセチル基が開始モジュールのATドメインの触媒により同モジュールのACPドメイン上に結合する。
伸長段階:
- 開始段階が終わると、ポリケチド(開始段階ではアセチル基)は開始モジュールのACPドメインから、次のモジュールのKSドメインの触媒によりこのKSドメインへと移動させられる。
- 伸長段階の基質は通常、マロニルCoAかメチルマロニルCoAであり、ATドメインの触媒によりACPドメインへと結合する。
- ACPドメインと結合した基質は、KSドメインに触媒されることで、KSドメインと結合したポリケチドと二酸化炭素の排出を伴うクライゼン縮合する。この縮合でポリケチド鎖は基質のケトン部分を付加され、伸長する。縮合反応は同一モジュールのKSドメインとATドメイン間で触媒され、新たに伸張したポリケチド鎖はATドメインへと移動する。移動したポリケチド鎖は、次のモジュールのKSドメインへ移動し上記と同様の反応が触媒されるため、ポリケチド鎖は鎖長を伸ばしながら場所を一つずらして移動する。
- 各モジュールでは必要に応じて修飾ドメインが働き、ポリケチド鎖の断片を変化させる。KRドメインはβ-ケト基をβ-ヒドロキシル基に還元し、DHドメインは断片を脱水することでα-β-不飽和アルケンにし、ERドメインはα-β-二重結合を単結合に還元する。これらの修飾ドメインが実際に作用するのは伸長部分ではなく、その直前に伸長部分だった部分(直前の伸長反応の現場となったモジュールと結合していたときの伸長基質)であることに注意が必要。
- 以上の工程は各伸長モジュールで繰り返される。
- 注意:この工程はI型のモジュール型のものであり、反復型では単一モジュール上で繰り返し触媒される。
終止段階
- ACPドメインからTEドメインへとポリケチドが移動する。
- TEドメイン上で加水分解、または環化反応が触媒され最終生成物が放出される。
薬理学[編集]
ポリケチド合成酵素は、化学療法に用いられる天然低分子を合成することができる[3] 。例えば、テトラサイクリンやマクロライドといった多くの一般的な抗生物質である。重要なポリケチドは他にシロリムス(免疫抑制剤)、エリスロマイシン(抗生物質)、ロバスタチン(抗コレステロール薬)、エポチロンB(抗がん剤)がある[4]。
重要性[編集]
ポリケチド合成酵素の産物には抗生物質や抗真菌物質、抗腫瘍物質、捕食者に対する防御物質などが含まれる。細菌や真菌、植物では未発見のポリケチド合成経路が多いとみられている[5][6] 。未知のポリケチドの多くは細菌に存在することが示唆されている[7][8]。
脚注[編集]
- ↑ Khosla, C.; Gokhale, R. S.; Jacobsen, J. R.; Cane, D. E. (1999). “Tolerance and Specificity of Polyketide Synthases”. Annual Review of Biochemistry 68: 219–253. . .
- ↑ Jenke-Kodama, H.; Sandmann, A.; Müller, R.; Dittmann, E. (2005). “Evolutionary Implications of Bacterial Polyketide Synthases”. Molecular Biology and Evolution 22 (10): 2027–2039. . .
- ↑ Koehn, F. E.; Carter, G. T. (2005). “The evolving role of natural products in drug discovery”. Nature Reviews Drug Discovery 4 (3): 206–220. . .
- ↑ Wawrik, B.; Kerkhof, L.; Zylstra, G. J.; Kukor, J. J. (2005). [ “Identification of Unique Type II Polyketide Synthase Genes in Soil”]. Applied and Environmental Microbiology 71 (5): 2232–2238. . . .
- ↑ Castoe, T. A.; Stephens, T.; Noonan, B. P.; Calestani, C. (2007). “A novel group of type I polyketide synthases (PKS) in animals and the complex phylogenomics of PKSs”. Gene 392 (1–2): 47–58. . .
- ↑ Ridley, C. P.; Lee, H. Y.; Khosla, C. (2008). [ “Chemical Ecology Special Feature: Evolution of polyketide synthases in bacteria”]. Proceedings of the National Academy of Sciences 105 (12): 4595–4600. . . .
- ↑ Metsä-Ketelä, M.; Salo, V.; Halo, L.; Hautala, A.; Hakala, J.; Mäntsälä, P.; Ylihonko, K. (1999). “An efficient approach for screening minimal PKS genes from Streptomyces”. FEMS microbiology letters 180 (1): 1–6. . .
- ↑ Wawrik, B.; Kutliev, D.; Abdivasievna, U. A.; Kukor, J. J.; Zylstra, G. J.; Kerkhof, L. (2007). [ “Biogeography of Actinomycete Communities and Type II Polyketide Synthase Genes in Soils Collected in New Jersey and Central Asia”]. Applied and Environmental Microbiology 73 (9): 2982–2989. . . .